必赢唯一官方网站病毒学和疫苗研究中心
一、研究方向
病毒感染引起的新发突发传染病日益频发,严重威胁着人类健康,给公共卫生安全造成了巨大的威胁。然而,针对病毒广谱而高效的抗病毒药物极其缺乏;同时,病毒耐药株的快速出现也给现有抗病毒药物带来了极大挑战。因此,迫切需要解析和澄清病毒的感染分子机制,并研发新型广谱抗病毒药物来有效应对病毒传染病的发生。
本团队聚焦于重要的人类和动物病毒(包括人副流感病毒、呼吸道合胞病毒、寨卡病毒、肠道病毒71型、新冠病毒、埃博拉病毒、尼帕病毒、乙型肝炎病毒等)的感染、复制与致病机制的研究,解析病毒在宿主细胞内的复制、组装、释放及病毒与宿主细胞的相互作用机制;结合结构生物学、生物信息学发现和鉴定新的抗病毒治疗靶点,在筛选传统抗病毒小分子药物的同时还开展包括纳米颗粒疫苗和RNA疫苗在内的多种新型预防和治疗性抗病毒药物的研发。

二、团队成员

|
陈明周,二级教授,博士生导师。国家杰出青年科学基金项目获得者、教育部“新世纪优秀人才”、湖北省“楚天学者”特聘教授、必赢唯一官方网站生物学首席科学家;现任必赢集团网站院长;曾任武汉大学必赢集团网站副院长、病毒学国家重点实验室副主任;现担任国际期刊 Journal of Virology 和 Virologica Sinica 编委、Frontiers in Cellular and Infection Microbiology 副主编。长期从事病毒感染和致病的分子机制研究:解析了病毒“复制细胞器”生物发生与稳态调控的分子机制;筛选并发现了多个广谱的抗呼吸道病毒抑制剂和多肽。以通讯作者在Cell Host & Microbe、Nature Communications、Cell Discovery、Autophagy、Cell Reports、Protein & Cell、PLoS Pathogens、Journal of Virology等国际权威期刊发表论文40多篇。先后主持国家杰出青年科学基金项目、国家自然科学基金重点项目、科技部国家重点研发计划项目课题、国家自然科学基金区域联合基金项目、教育部新世纪优秀人才支持计划、湖北省自然科学基金创新群体、湖北省自然科学杰出青年基金等多项国家级和省部级科研项目。 Email:chenmz@hubu.edu.cn |

|
覃雅丽,教授,博士生导师。2015-2023年武汉大学生科院工作,2023年8月入职必赢唯一官方网站生科院,主要从事病毒感染与宿主互作,病毒调节宿主脂质代谢的分子机制研究与抗病毒药物及新型疫苗研发。主持国家基金委面上项目 2 项, 区域联合基金项目 1 项,湖北省自然基金面上项目 1 项,参与科技部重点研发计划 1 项;以通讯作者在Nature Communications、Cell Reports、PLoS Pathogens、Journal of Virology、 Cell Insight和 Viruses等国际权威期刊上发表论文多篇。 Email:yqin@hubu.edu.cn |

|
张胜威,特任研究员,硕士生导师。湖北省生物工程学会会员,中国生物化学与分子生物学学会会员。2017年10月-2019年2月在宾夕法尼亚大学Perelman医学院从事博士后研究工作。2023年11月进入必赢集团网站任教。主要从病毒-宿主互作的角度,利用免疫共沉淀(Co-IP)联合质谱分析筛选与病毒蛋白互作的宿主因子,并通过CRISPR-Cas9敲除、活细胞成像等技术验证其对病毒RNA合成(基因组复制/转录)向病毒粒子组装/出芽动态转换的调控功能;解析宿主来源或病毒编码的RNA表观修饰动态调控病毒复制与免疫逃逸的具体机制,定位病毒RNA的关键修饰位点,阐明其作用的分子机制,为抗病毒策略提供理论依据。在国际著名期刊如 PLoS Pathogens、Journal of Virology、Viruses、Virology 上以第一作者或共同第一作者身份发表SCI论文6篇,同时主持国家自然科学基金面上项目1项、国家自然科学基金青年项目1项、省级自然科学基金面上项目1项,参与国家自然科学基金项目3项;参编了第四版《分子诊断学》数字化教材、《现场医护POC现状和进展》等多部专业教材和著作。 Email:zhangsw@hubu.edu.cn |

|
胡柱龙,副教授,武汉英才计划优秀青年人才(2024)。2012-2018年于武汉大学获得博士学位,2018-2022年在中山大学肿瘤防治中心从事博士后研究,2023年8月进入必赢集团网站任教。专注于新突发病毒靶标抗原的智能化改造,并致力于创新型自组装纳米颗粒疫苗的设计与研发。曾以呼吸道合胞病毒PreF蛋白为靶点,基于mi3、I53-50等多种自组装纳米颗粒平台开发出新型疫苗;基于VSV病毒载体平台开发出针对鼻咽癌病毒(EBV)的新型疫苗;阐明了人副流感病毒(HPIV3)通过调控应激颗粒的形成逃逸宿主抗病毒免疫反应的分子机制。为预防呼吸道病毒感染以及鼻咽癌的防治提供了新的研究策略和理论基础。近5年来,主持国家自然科学基金青年项目1项(2022年),中国博士后科学基金面上项目1项(2018年),广东省自然科学基金青年项目1项(2021年)。以第一或通讯作者在病毒学权威期刊PLoS Pathogens和Journal of Virology发表SCI论文2篇。 Email:huzl@hubu.edu.cn |

|
李智菲,副教授,湖北省“楚天英才计划”楚天学者(2024),武汉英才计划优秀青年人才(2024)。2019年12月毕业于武汉大学微生物学专业,获理学博士,2020年1月-2023年7月在武汉大学必赢集团网站从事博士后研究。2023年8月进入必赢集团网站任教。主要聚集重要人类及动物病毒的感染及致病机制,深入解析病毒基因组的复制工厂(复制细胞器)的生物合成及功能发挥的机制,挖掘病毒复制过程中的关键宿主因子,并针对筛选鉴定的关键靶标设计和研发新型抗病毒药物。在主流学术期刊Cell Host & Microbe、Cell Reports、Cell Insight、Journal of Virology、Virologica Sinca发表SCI论文5篇。主持国家自然科学基金原创探索项目1项,国家自然科学基金青年基金项目1项、必赢唯一官方网站双一流建设高校重点项目1项、中国博士后面上项目1项、湖北省创新博士后资助项目1项,湖北省博士后先锋人才项目1项。 Email:zhifeili@hubu.edu.cn |

|
张林亮,副教授,湖北省“楚天英才计划”楚天学者(2023),湖北省生物工程学会会员。长期从事表观遗传修饰调控病毒感染和致病性的研究,结合类器官和小鼠模型以及临床观察,利用RNA-seq、蛋白质组学、单细胞测序、生信分析等技术手段研究RNA病毒(包括高致病性以及新发突发病毒)致病机理以及抗病毒小分子药物的筛选,系统解析蛋白质翻译后修饰调节病毒复制的分子机制以及与宿主的相互作用关系:1、解析寨卡病毒非结构蛋白的泛素化抑制内质网自噬和应激颗粒的形成提高病毒致病性的分子机制;2、发现乙酰化是埃博拉病毒出芽的直接驱动力,阐明泛素化调控尼帕病毒基质蛋白出核转运的分子机制;3、提出泛素化调节人副流感病毒和新冠病毒基质蛋白作为自噬受体、诱导线粒体自噬,实现免疫逃逸的新理论;4、系统总结乙酰化修饰在病毒生命周期的作用以及病毒操纵线粒体自噬的策略。相关研究成果发表在Cell Host & Microbe、Nature Communications、Autophagy、Signal Transduction and Targeted Therapy、PLoS Pathogens等病毒学领域权威期刊上。主持纵向科研项目4项,包括国家自然科学基金青年项目等。 Email: zlinliang@hubu.edu.cn |

|
郑颖城,特任副研究员。2020年6月毕业于武汉大学免疫学专业,获得医学博士学位。2020年7月-2023年8月在武汉大学医学病毒研究所从事博士后研究。2023年10月进入必赢集团网站任教。目前的研究主要涉及以下三个方向:1. DNA病毒感染与脂质代谢重编程:以乙型肝炎病毒为代表的多种DNA病毒可引发长期慢性感染性疾病。在这些病毒感染过程中,宿主细胞和机体的脂质代谢会发生显著改变。本方向的核心研究内容是揭示病毒如何影响脂质代谢,以及这种影响与其引发疾病之间的关系和机制;2. 脂质代谢在致瘤DNA病毒调控肿瘤发生发展中的作用:目前已有研究表明,包括人乳头瘤病毒和乙型肝炎病毒在内的多种DNA病毒能够诱发肿瘤。这些致瘤DNA病毒可导致胆固醇、自由脂肪酸等多种脂质相关代谢途径发生改变。本方向的主要研究内容是探索这些代谢改变在肿瘤发生和发展中的作用机制;3. 长期慢性DNA病毒感染的新型治疗策略研发:某些DNA病毒(如乙型肝炎病毒和人乳头瘤病毒)能够通过多种机制在宿主细胞内长期潜伏,甚至将其基因整合入宿主染色体,这使得病毒或病毒抗原的彻底清除极为困难。针对这一难题,开发有效的新型治疗策略是该研究方向的核心内容。以第一作者身份在PLoS Pathogens、Journal of Virology等国际知名学术期刊发表SCI论文多篇。 Email:zhengyingcheng@hubu.edu.cn |

|
乔嘉璐,副教授,硕士生导师。湖北省免疫学学会会员,Frontiers in Immunology客座编辑。2018年6月毕业于武汉大学微生物学专业,获理学博士。 2024年5月进入必赢集团网站任教。 主要从事病毒与宿主互作机制研究,抗病毒治疗新策略开发和抗病毒药物的前期筛选。前期揭示了新冠病毒多个非结构蛋白通过不同机制干扰宿主正常生理功能的分子机制, 同时筛选发现了多个具有抑制新冠病毒感染的先导化合物。在Journal of Agricultural and Food Chemistry、Virologica Sinica、Cellular Signalling、Frontiers in Immunology、AIDS research and human retroviruses 等国际权威杂志上发表高水平学术论文10余篇,申请发明专利2项。主持国家自然科学基金青年项目1项、省市级课题3项。 Email: jialuqiao@hubu.edu.cn |

|
胡云虹,副教授,硕士生导师。2016年6月于武汉大学必赢集团网站获得博士学位。主要从事细胞抗病毒天然免疫应答及细胞炎症反应的相关研究,鉴定参与这些反应的蛋白质并解析其发挥作用的分子机制:1、发现内体蛋白WDFY1可作为桥梁蛋白参与受体TLR3/4招募接头蛋白TRIF;2、阐明肿瘤相关蛋白SPOP通过与免疫关键蛋白MyD88相互作用,从而介导炎症消解;3、构建工程菌TIB@PD1,开发了一种在肿瘤部位时空特异表达PD1的肿瘤免疫治疗方法。以第一作者或通讯作者身份在EMBO Reports、Cellular & Molecular Immunology、Biotechnology Letter等杂志上发表高水平学术论文7篇。主持纵向科研项目3项,包括国家自然科学基金青年项目等。 Email: huyunhong@hubu.edu.cn |
三、代表性研究成果
(一)阐明病毒-宿主相互作用的分子机制
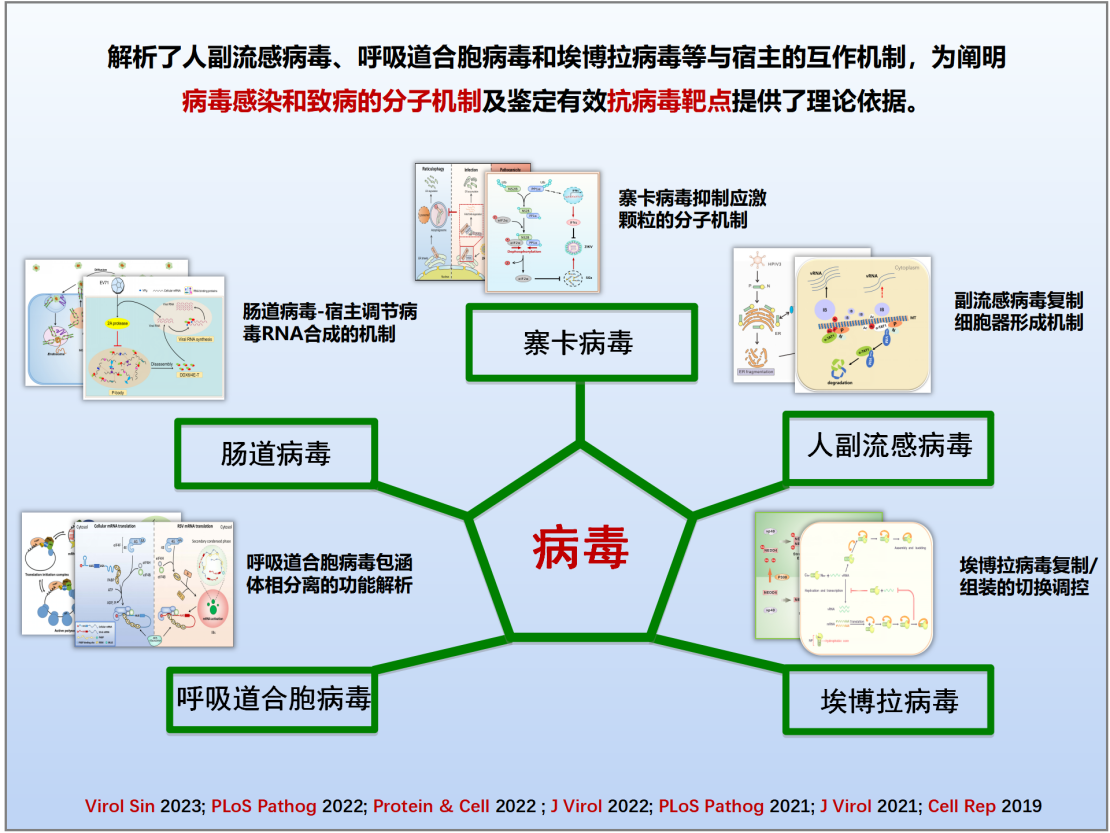
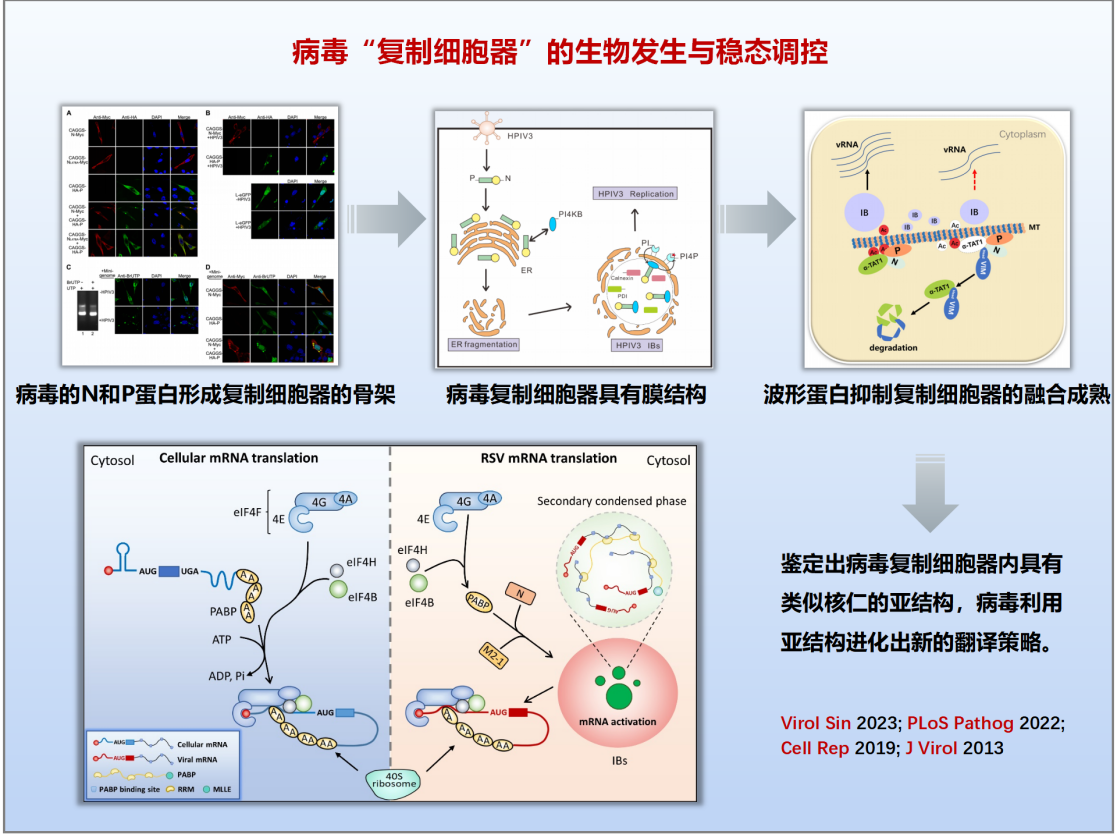
(二)揭示病毒“复制细胞器”生物发生与稳态调控
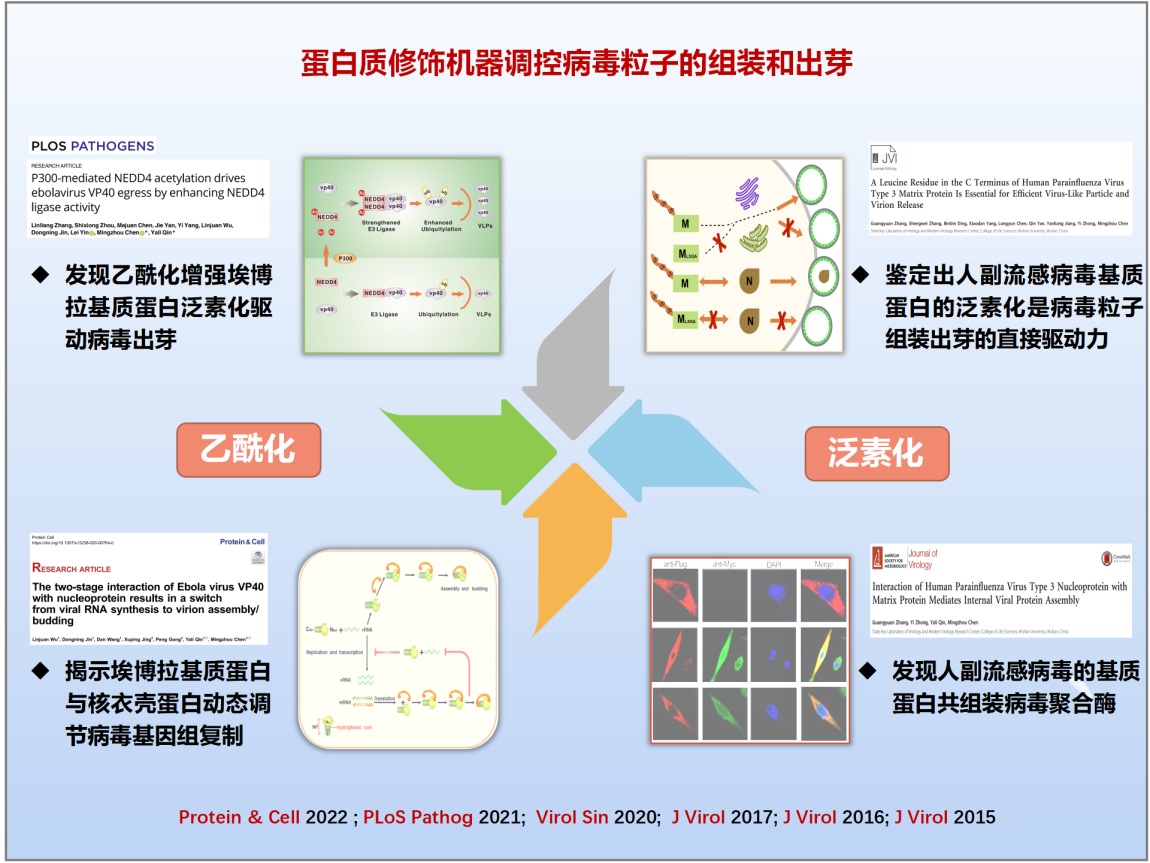
(三)发现病毒粒子组装和释放的新机制
(四)提出RNA病毒抑制干扰素产生新理论
(五)新型疫苗和抗病毒药物研发
四、科研项目(近5年)
1、国家重点研发计划 “合成生物学” 专项:自组装纳米颗粒广谱疫苗设计与合成, 2024.12-2029.11,550万
2、国家自然科学基金区域联合基金项目:埃博拉和尼帕病毒基质蛋白翻译后修饰调控病毒粒子出芽的分子机制,2025.01-2028.12,260万
3、国家自然科学基金原创探索类项目:负链RNA病毒诱导“病毒巢”重塑的分子机制研究,2024.01-2025.12,160万
4、国家自然科学基金重点项目:人副流感病毒3型复制细胞器生物合成及功能发挥的分子机制,2022.01-2026.12,290万
5、国家重点研发计划 “病原学与防疫技术体系研究” 专项:病毒复制与宿主相互作用研究及药物靶点发现, 2021.12-2024.11,687万
6、国家自然科学基金区域联合基金项目:新冠病毒诱导脂噬重排脂质流向以调控复制细胞器生物发生及膜特性的机制研究,2023.01-2026.12,255万
7、国家杰出青年科学基金项目:RNA病毒感染和致病的分子机制,2019.01-2023.12,400万
8、武汉市自然科学基金:病毒感染致病机制及抗病毒药物的研发,2024.06,200万
9、湖北省重点研发计划:靶向宿主囊泡运输途径关键调节因子RAB11的广谱型抗呼吸道病毒多肽研发,2023.01-2025.12,100万
10、国家自然科学基金面上项目:人副流感病毒3型病毒合胞体内细胞死亡进程及其调控的分子机制,2025.01-2028.12,50万
11、国家自然科学基金面上项目:波形蛋白调控人副流感病毒3型RNA合成切换至病毒粒子组装/出芽的分子机制,2025.01-2028.12,49万
12、湖北江夏实验室生物安全重点研发:抗尼帕病毒小分子药物的研发,2024.02-2026.01,50万
13、国家自然科学基金青年项目:EB 病毒蛋白BRRF2 通过外泌体抑制天然免疫的作用及机制,2023.01-2025.12,30 万
14、国家自然科学基金青年项目:去乙酰化酶HDAC10抑制埃博拉病毒基质蛋白出芽的机制研究,2023.01-2025.12,30万
15、国家自然科学基金青年项目:SARS-CoV-2非结构蛋白Nsp5与Bcl2相互作用诱导线粒体损伤激活NLRP3炎症小体的分子机制研究,2022.01-2024.12,30万
16、国家自然科学基金青年项目:人副流感病毒3型诱导未折叠蛋白反应的机制研究,2021.01-2023.12, 30万
17、国家重点研发计划子课题:虫媒病毒感染和传播机制及防治干预靶点的发现,2021.12-2025.11,64万
五、研究论文(近5年)
1、 Zhang, L., Qin, Y., & Chen, M. (2025). Flavivirus NS2A orchestrates reticulophagy to enhance viral pathogenicity. Autophagy, 1-2. https://doi.org/10.1080/15548627.2025.2457112
2、 Zhou, S., Hui, X., Wang, W., Zhao, C., Jin, M., Qin, Y., & Chen, M. (2025). SARS-CoV-2 and HCoV-OC43 regulate host m6A modification via activation of the mTORC1 signalling pathway to facilitate viral replication. Emerging Microbes & Infections, 14(1). https://doi.org/10.1080/22221751.2024.2447620
3、 Jin, D., Zhang, L., Peng, C., He, M., Wang, W., Li, Z., Liu, C., Du, J., Zhou, J., Yin, L., Shan, C., Qin, Y., & Chen, M. (2024). The E3 ligase RAD18-mediated ubiquitination of henipavirus matrix protein promotes its nuclear-cytoplasmic trafficking and viral egress. Emerging Microbes & Infections, 14(1). https://doi.org/10.1080/22221751.2024.2432344
4、 Zhang, L., Wang, H., Han, C., Dong, Q., Yan, J., Guo, W., Shan, C., Zhao, W., Chen, P., Huang, R., Wu, Y., Chen, Y., Qin, Y., & Chen, M. (2024). AMFR-mediated Flavivirus NS2A ubiquitination subverts ER-phagy to augment viral pathogenicity. Nature Communications, 15(1). https://doi.org/10.1038/s41467-024-54010-w
5、 Wu, X., Zhang, L., Liu, C., Cheng, Q., Zhao, W., Chen, P., Qin, Y., & Chen, M. (2024). The NS2B-PP1α-eIF2α axis: Inhibiting stress granule formation and Boosting Zika virus replication. PLOS Pathogens, 20(6). https://doi.org/10.1371/journal.ppat.1012355
6、 Han, Y., Zhou, H., Liu, C., Wang, W., Qin, Y., & Chen, M. (2024). SARS-CoV-2 N protein coordinates viral particle assembly through multiple domains. J Virol, 98(11), e0103624. https://doi.org/10.1128/jvi.01036-24
7、 Zheng, Y., Wang, M., Yin, J., Duan, Y., Wu, C., Xu, Z., Bu, Y., Wang, J., Chen, Q., Zhu, G., Zhao, K., Zhang, L., Hua, R., Xu, Y., Hu, X., Cheng, X., & Xia, Y. (2024). Hepatitis B virus RNAs co-opt ELAVL1 for stabilization and CRM1-dependent nuclear export. PLOS Pathogens, 20(2). https://doi.org/10.1371/journal.ppat.1011999
8、 Zheng, Y., Wang, M., Li, S., Bu, Y., Xu, Z., Zhu, G., Wu, C., Zhao, K., Li, A., Chen, Q., Wang, J., Hua, R., Teng, Y., Zhao, L., Cheng, X., & Xia, Y. (2023). Hepatitis B virus hijacks TSG101 to facilitate egress via multiple vesicle bodies. PLOS Pathogens, 19(5). https://doi.org/10.1371/journal.ppat.1011382
9、 Zhang, Q., Ye, H., Liu, C., Zhou, H., He, M., Liang, X., Zhou, Y., Wang, K., Qin, Y., Li, Z., & Chen, M. (2023). PABP-driven secondary condensed phase within RSV inclusion bodies activates viral mRNAs for ribosomal recruitment. Virol Sin, 39(2), 235-250. https://doi.org/10.1016/j.virs.2023.12.001
10、 Li, Z., Zheng, M., He, Z., Qin, Y., & Chen, M. (2023). Morphogenesis and functional organization of viral inclusion bodies. Cell Insight, 2(3). https://doi.org/10.1016/j.cellin.2023.100103
11、 Zong, S., Wu, Y., Li, W., You, Q., Peng, Q., Wang, C., Wan, P., Bai, T., Ma, Y., Sun, B., & Qiao, J. (2023). SARS-CoV-2 Nsp8 induces mitophagy by damaging mitochondria. Virologica Sinica, 38(4), 520-530. https://doi.org/10.1016/j.virs.2023.05.003
12、 Liu, P., Zhang, S., Ma, J., Jin, D., Qin, Y., & Chen, M. (2022). Vimentin inhibits α-tubulin acetylation via enhancing α-TAT1 degradation to suppress the replication of human parainfluenza virus type 3. PLOS Pathogens, 18(9). https://doi.org/10.1371/journal.ppat.1010856
13、 Kong, X. W., Zhang, X., Bu, G. L., Xu, H. Q., Kang, Y. F., Sun, C., Zhu, Q. Y., Ma, R. B., Liu, Z., Zeng, Y. X., Zeng, M. S., & Hu, Z. L. (2022). Vesicular Stomatitis Virus-Based Epstein-Barr Virus Vaccines Elicit Strong Protective Immune Responses. J Virol, 96(9), e0033622. https://doi.org/10.1128/jvi.00336-22
14、 Guo, D., Yu, X., Wang, D., Li, Z., Zhou, Y., Xu, G., Yuan, B., Qin, Y., & Chen, M. (2022). SLC35B2 Acts in a Dual Role in the Host Sulfation Required for EV71 Infection. J Virol, 96(9), e0204221. https://doi.org/10.1128/jvi.02042-21
15、 Fan, S., Xu, Z., Liu, P., Qin, Y., Chen, M., & López, S. (2021). Enterovirus 71 2A Protease Inhibits P-Body Formation To Promote Viral RNA Synthesis. Journal of Virology, 95(19). https://doi.org/10.1128/jvi.00922-21
16、 Zhang, L., Zhou, S., Chen, M., Yan, J., Yang, Y., Wu, L., Jin, D., Yin, L., Chen, M., & Qin, Y. (2021). P300-mediated NEDD4 acetylation drives ebolavirus VP40 egress by enhancing NEDD4 ligase activity. PLOS Pathogens, 17(6). https://doi.org/10.1371/journal.ppat.1009616
17、 Hui, X., Zhang, L., Cao, L., Huang, K., Zhao, Y., Zhang, Y., Chen, X., Lin, X., Chen, M., & Jin, M. (2021). SARS-CoV-2 promote autophagy to suppress type I interferon response. Signal Transduction and Targeted Therapy, 6(1). https://doi.org/10.1038/s41392-021-00574-8
18、 Wu, L., Jin, D., Wang, D., Jing, X., Gong, P., Qin, Y., & Chen, M. (2020). The two-stage interaction of Ebola virus VP40 with nucleoprotein results in a switch from viral RNA synthesis to virion assembly/budding. Protein & Cell, 13(2), 120-140. https://doi.org/10.1007/s13238-020-00764-0
19、 Cheng, Q., Huai, W., Wu, X., & Chen, M. (2020). Sumoylation of Human Parainfluenza Virus Type 3 Phosphoprotein Correlates with A Reduction in Viral Replication. Virologica Sinica, 36(3), 438-448. https://doi.org/10.1007/s12250-020-00314-2
20、 Zheng, Y., Zhu, G., Yan, J., Tang, Y., Han, S., Yin, J., Peng, B., He, X., Liu, W., & Silvestri, G. (2020). The Late Domain of Prototype Foamy Virus Gag Facilitates Autophagic Clearance of Stress Granules by Promoting Amphisome Formation. Journal of Virology, 94(7). https://doi.org/10.1128/jvi.01719-19
21、 Li, Z., Guo, D., Qin, Y., & Chen, M. (2019). PI4KB on Inclusion Bodies Formed by ER Membrane Remodeling Facilitates Replication of Human Parainfluenza Virus Type 3. Cell Reports, 29(8), 2229-2242.e2224. https://doi.org/10.1016/j.celrep.2019.10.052
22、 Zhang, S., Pei, Y., Lang, F., Sun, K., Singh, R. K., Lamplugh, Z. L., Saha, A., & Robertson, E. S. (2019). EBNA3C facilitates RASSF1A downregulation through ubiquitin-mediated degradation and promoter hypermethylation to drive B-cell proliferation. PLOS Pathogens, 15(1). https://doi.org/10.1371/journal.ppat.1007514
23、 Ding, B., Zhang, L., Li, Z., Zhong, Y., Tang, Q., Qin, Y., & Chen, M. (2017). The Matrix Protein of Human Parainfluenza Virus Type 3 Induces Mitophagy that Suppresses Interferon Responses. Cell Host & Microbe, 21(4), 538-547.e534. https://doi.org/10.1016/j.chom.2017.03.004
24、 Ding, B., Zhang, G., Yang, X., Zhang, S., Chen, L., Yan, Q., Xu, M., Banerjee, Amiya K., & Chen, M. (2014). Phosphoprotein of Human Parainfluenza Virus Type 3 Blocks Autophagosome-Lysosome Fusion to Increase Virus Production. Cell Host & Microbe, 15(5), 564-577. https://doi.org/10.1016/j.chom.2014.04.004





